
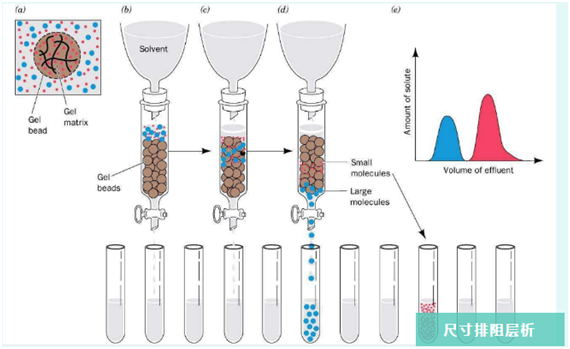
前处理
凝胶分离模式主要是靠分子量大小差异来达到分离的目的,前处理就显得尤为重要。主要方式为对样品进行离心和过滤,离心可以除去大部分块状物,再用针式滤器进行过滤即可。
溶液交换量
控制上样体积,以不超过柱床体积30%为宜;
关注样品溶液体积浓度,可以分多次上样,注意每次上样时间间隔,可根据电导色谱峰确定下一次上样时间。
提高分辨率
1.保证填料装填匀实;
2.增加柱床高度;
3.控制上样体积,以不超过柱床体积5%为宜;
4.关注样品黏度和取代溶液黏度是否保持一致;
5.根据样品特点选择更优的取代溶液,优化取代溶液的离子强度和亲水性;
优化对称性
1.保证填料装填匀实,拖尾→填料较松丨适当增加装柱压力,前沿反之;
2.使用太久柱料脏了→填料再生。
出现肩峰
1.柱床:重新装柱或反冲;
2.筛板:超声清洗筛板;
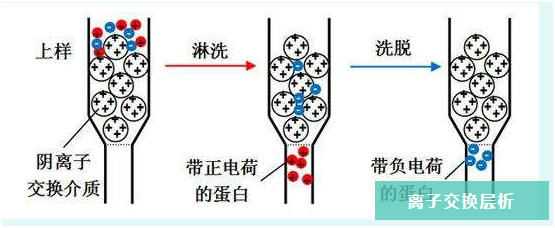
前处理
凝胶分离模式主要是靠分子量大小差异来达到分离的目的,前处理就显得尤为重要。主要方式为对样品进行离心和过滤,离心可以除去大部分块状物,再用针式滤器进行过滤即可。
溶液交换量
控制上样体积,以不超过柱床体积30%为宜;
关注样品溶液体积浓度,可以分多次上样,注意每次上样时间间隔,可根据电导色谱峰确定下一次上样时间。
提高分辨率
1.保证填料装填匀实;
2.增加柱床高度;
3.控制上样体积,以不超过柱床体积5%为宜;
4.关注样品黏度和取代溶液黏度是否保持一致;
5.根据样品特点选择更优的取代溶液,优化取代溶液的离子强度和亲水性;
优化对称性
1.保证填料装填匀实,拖尾→填料较松丨适当增加装柱压力,前沿反之;
2.使用太久柱料脏了→填料再生。
出现肩峰
1.柱床:重新装柱或反冲;
2.筛板:超声清洗筛板;
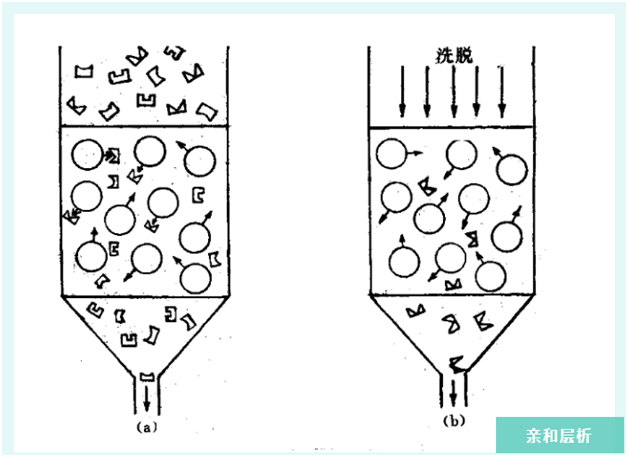
蛋白质和亲和介质不结合
1. 标签未翻译或标签被包裹在结构内
需要检查质粒序列或将标签移到其他位置,标签移到其它位置仍被包裹在结构内部时,就要将标签暴露出来
2. 优化结合缓冲液及充分平衡层析柱
调整缓冲液(如金属鳌合介质和His标签蛋白结合时pH应在7.3-8.5之间,在如肝素亲和介质和DNA聚合酶结合时盐浓度太高影响结合,应控制在50mM以下)。
层析柱没平衡好,柱床体系中的环境如pH,离子强度也会影响结合,层析上样前要充分平衡层析柱。
3. 增加结合时间
降低上样流速让蛋白和介质有充分的接触时间。
4. 更换更优层析介质
亲和介质分类,一类是特异性结合一种蛋白,另一类是特异性结合一类蛋白。(如蛋白a介质结合一种蛋白,而肝素个质结合一类蛋白。所以选择的时候我们一定要了解其原理。)
蛋白结合在柱子未洗脱出
1. 蛋白和介质结合力过强
增加洗脱强度(his蛋白和镍柱结合,可以增加取代基咪唑的浓度)。
2. 蛋白聚集在层析柱上
通过调整层析过程的缓冲液增加蛋白的稳定性,改善蛋白在层析柱上的状态。
聚集在层析柱上时就要对层析柱进行CIP清洗。
低分辨率(洗脱后纯度低)
1.层析过程流速的影响
调整层析过程的流速,流速影响蛋白质和介质的亲和力,层析时要选择合适的流速。
2.柱床未充分淋洗
上样后,要对柱床进行充分的淋洗,将未和介质结合的留在介质颗粒间隙,孔内的蛋白洗出来,再洗脱。
3.蛋白之间的非特性结合
优化体系缓冲液(比如加入10%的甘油等减少蛋白之间的非特异性结合)。
4.介质的非特异性结合
优化缓冲液,减少层析过程的非特异性结合(如His蛋白用金属鳌合填料纯化时,可以在缓冲液中加入300mM的氯化钠,减少蛋白和介质的非特异性结合)。
5.洗脱过程的影响
如肝素柱子洗脱过程中拉合适的盐梯度可以提高特异性,His标签蛋白和金属鳌合介质结合后,洗脱时拉咪唑梯度可以提高纯度。
蛋白质纯化过程中失活
1.蛋白去折叠或聚集
优化缓冲液使其利于蛋白质保持稳定。蛋白质在介质上的高密度下容易聚集可以添加一些蛋白的增溶剂等。
2.纯化过程中保持蛋白的活性的辅助因子被法除
如一些酶类的活性需要金属离子辅助其活性,在纯化过程中就要添加蛋白的活性辅助因子。